
ГАЛОГЕНЫ И ИХ СПОСОБ ПОЛУЧЕНИЯ
Автор reartyt , 3 Апреля, в в Решение заданий. Задание 1. Через раствор йодида калия в течение продолжительного времени пропускали струю хлора, а затем испытали раствор на присутствие свободного йода крахмалом, однако посинения не обнаружили. Дайте объяснение этому факту. Задание 2.



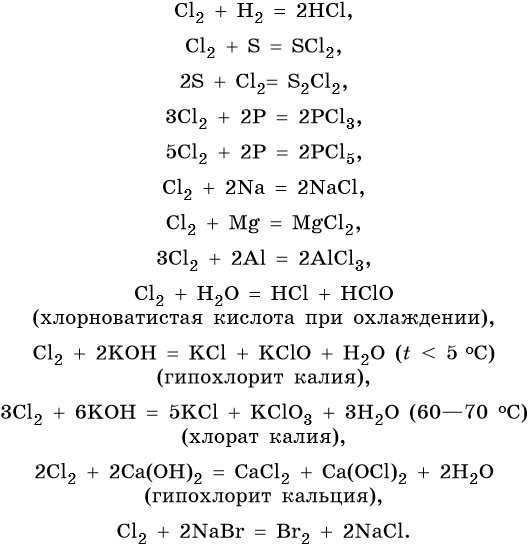
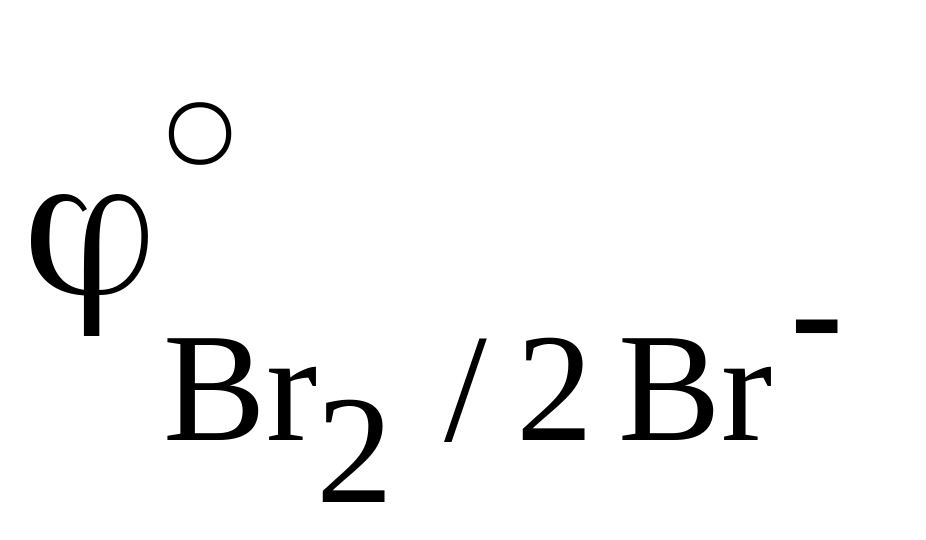




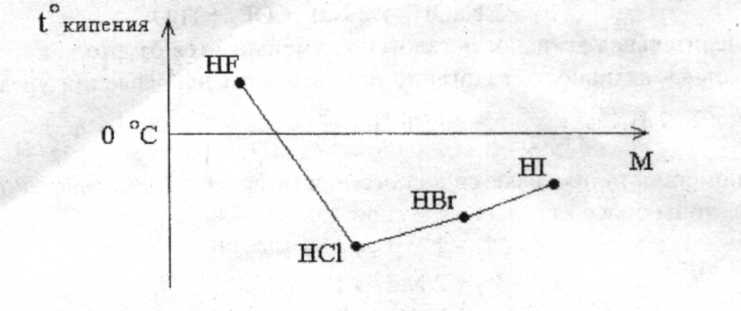
Галогеноводороды — газообразные при обычных условиях вещества. Она аномально велика вследствие образования очень прочных водородных связей в жидком фтороводороде. Из-за прочных водородных связей в жидком фтороводороде нет свободных ионов, и он не проводит электрический ток, являясь неэлектролитом. Во всех молекулах галогеноводородов имеются одинарные сильнополярные связи. При движении по группе сверху вниз полярность связи уменьшается, так как отрицательным концом диполя связи «водород-галоген» является галоген, а от фтора к иоду электроотрицательность существенно уменьшается.
- Для публикации сообщений создайте учётную запись или авторизуйтесь
- Валентность — это способность атома образовывать ковалентные химические связи.
- В ходящие в главную подгруппу VII группы элементы фтор, хлор, бром, йод и астат называются галогенами. У атомов галогенов во внешнем электронном слое по семь электронов: 2 на s-орбиталях и 5 на p-орбиталях ns 2 np 5.
- Мы предполагаем, что вам понравилась эта презентация.
- Галогены. Задачи 808 - 811
- К галогенам относятся элементы VIII группы периодической системы, атомы этих элементов содержат на внешнем энергетическом уровне семь электронов и до его завершения им недостает только одного электрона, поэтому галогены проявляют яркие окислительные свойства. Аналогично уменьшается и значение относительной электроотрицательности галогенов.
- Редакция Без Сменки Честно.
- Подгруппу галогенов составляют элементы фтор, хлор, бром и иод.
- Вам также будет интересно
- Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане. А ещё раздел с полезными материалами, календарь занятий и уведомления о предстоящих уроках.
- Непосредственно с кислородом галогены не соединяются.
- Соединения хлора, брома и иода с более электроотрицательным кислородом относятся к классу оксидов.


| Сравнительная характеристика свойств галогенов | 147 | Download Now Download to read offline. Recommended лек. |
| 3.1 Введение | 307 | Задача Исходя из строения атомов галогенов, указать, какие валентные состояния характерны для фтора, хлора, брома и йода. |
| Популярные статьи: | 347 | Кислоты типа ННаЮ — слабые, сильные окислители. Кислоты типа ННа10 3 — сильные одноосновные, сильные окислители. |
| 265 | Категория: Химия. Похожие презентации:. | |
| 16 | Основы общей химии. |
Регистрация Вход. Ответы Mail. Вопросы - лидеры. Любите ли вы при случае зло пошутить? Советское прошлое и капиталистическое настоящее 1 ставка.







Похожие статьи
- С чем носить сумку-почтальон - Сумки -почтальонки с фото кожаных женских сумок через плечо и моделей
- Как связать тапочки для гнома - Тапочки для гнома. Обсуждение на LiveInternet - Российский Сервис
- Какое понятие шире социализация или социальная адаптация почему
- Вязание шапочка для девочек - Коса «Рыбий хвост» - ИзюминкиИзюминки