Исследования биоэквивалентности в Москве
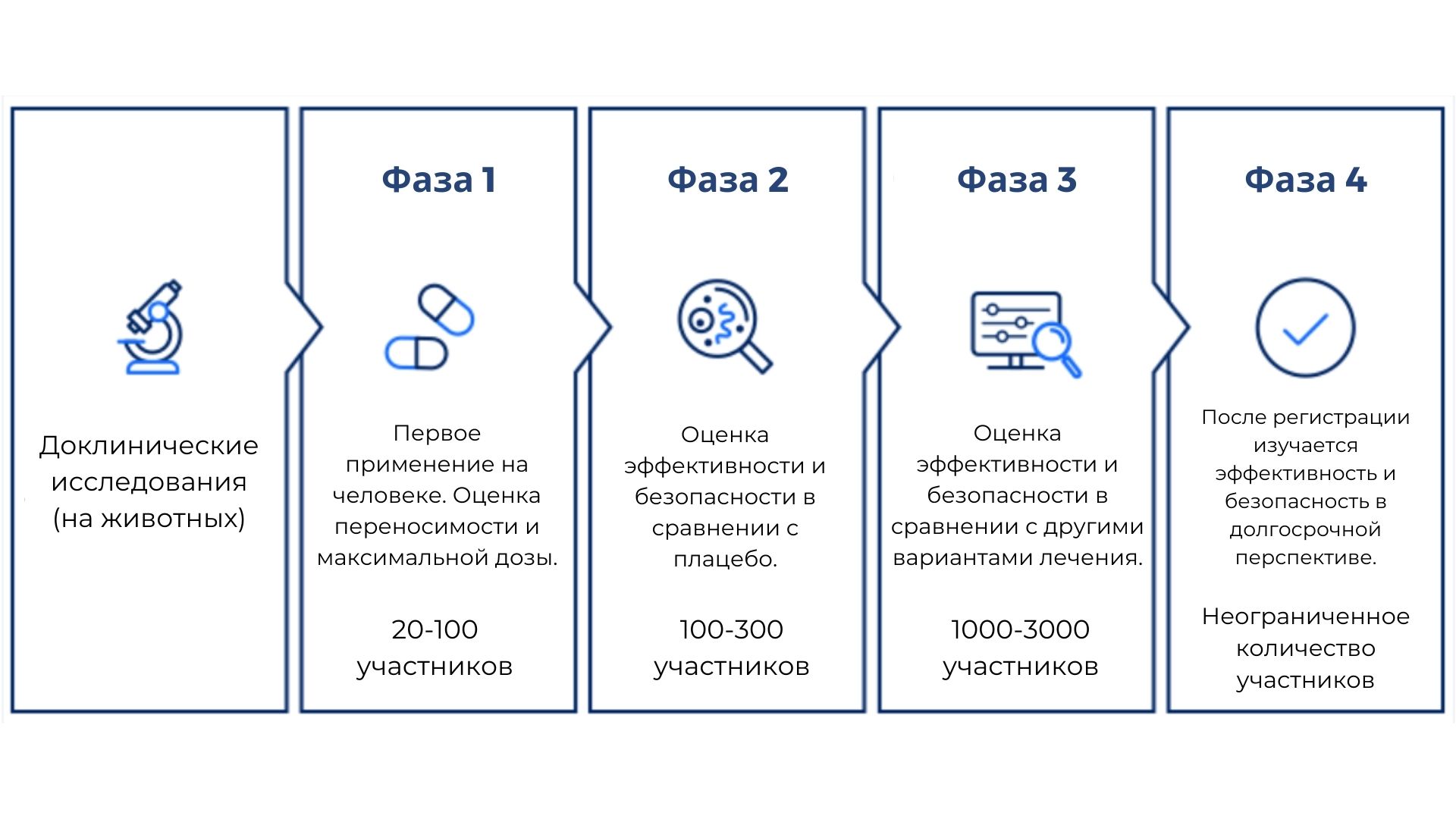
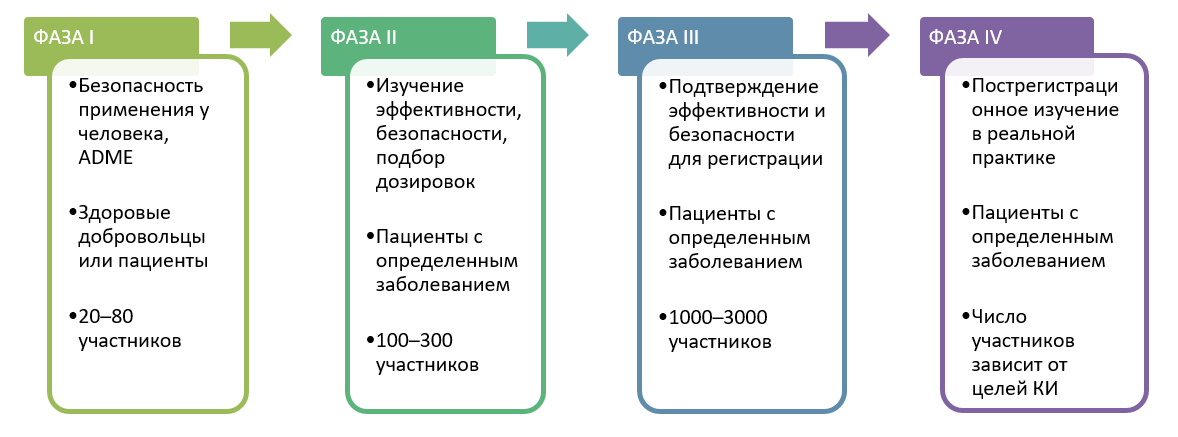
Команда ОСТ выполняет все необходимые услуги в рамках организации и проведения клинических исследований I—IV фазы, а также исследований биоэквивалентности. Каждый этап проекта от разработки дизайна исследования до регистрации препарата берется под полный контроль компании. Предоставляются услуги как «под ключ», так и по отдельным видам услуг. Клинические потребности клиентов — один из главных приоритетов компании.







Порядок выдачи разрешения на проведение клинического исследования лекарственного препарата для медицинского применения. Проект Решения Совета ЕЭК «О внесении изменений в Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза». О внесении изменений в Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза. Руководство по составлению документации по химическому и фармацевтическому качеству для исследуемых лекарственных средств, применяемых в клинических исследованиях. Проект приказа Министерства здравоохранения Российской Федерации Об утверждении методики определения размера платы за оказание услуги по проведению инспекций проверок клинических исследований лекарственных препаратов для медицинского применения на соответствие требованиям Правил надлежащей клинической практики Евразийского экономического союза.
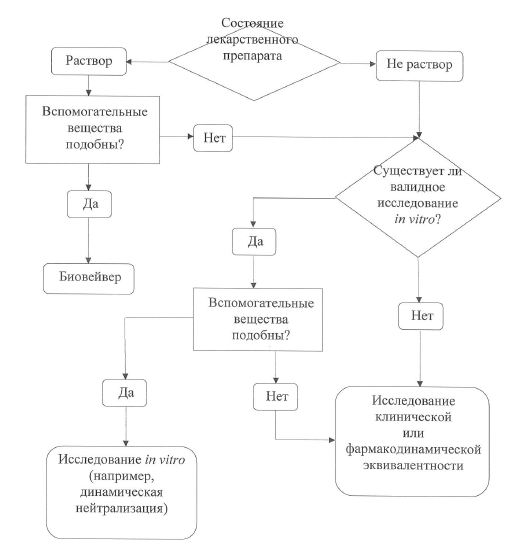






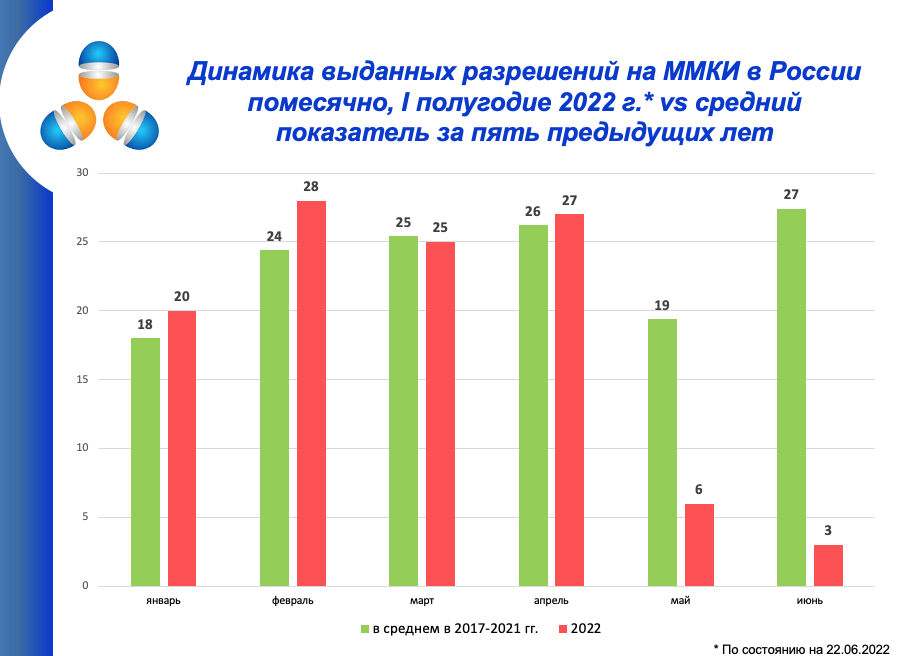


Правила проведения исследований биоэквивалентности лекарственных средств Евразийского экономического союза версия 2 от Минздравсоцразвития РФ, Москва ; Фармакокинет. United States Food and Drug Administration. Davit, D. Conner, B.