
Что представляет собой клиническое исследование
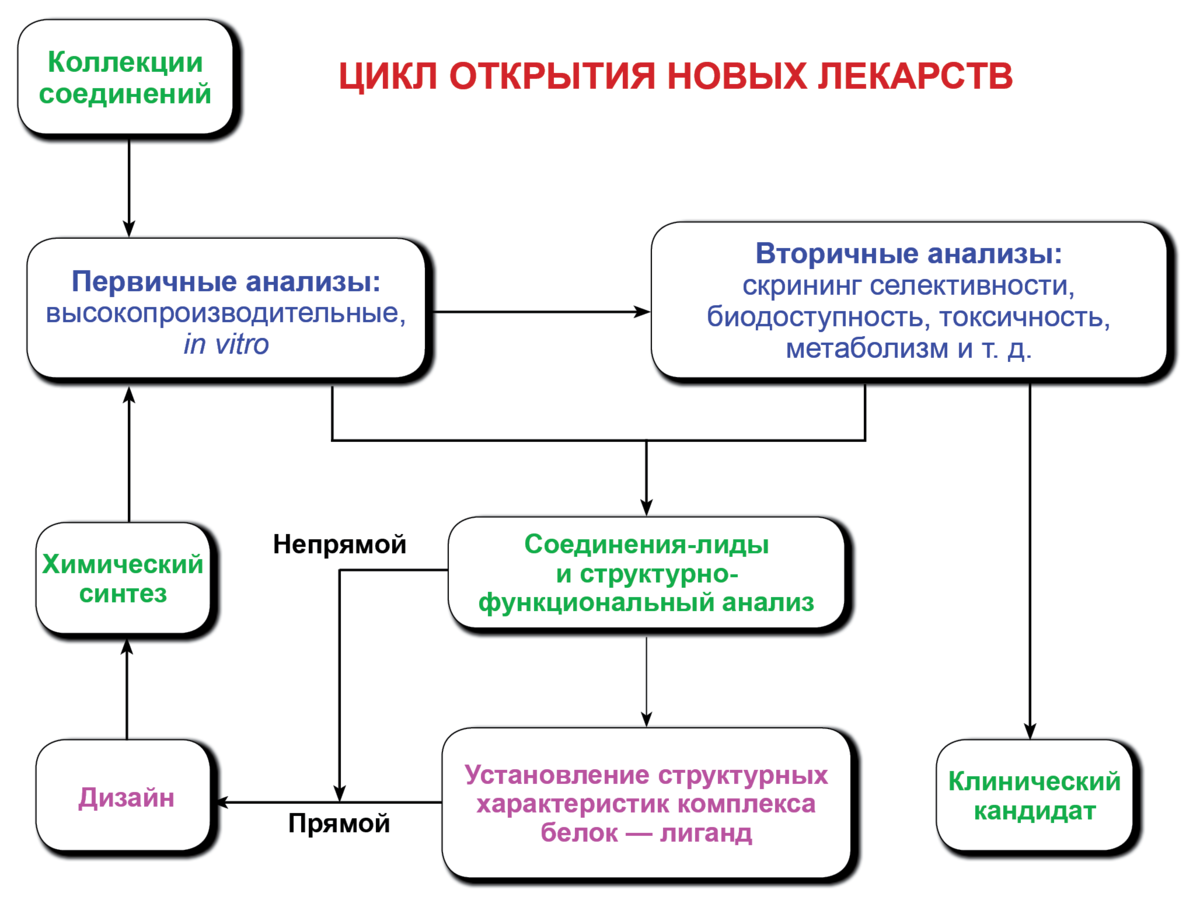
Современная медицина в своей работе использует принцип «доказательности», это значит, что любые лекарственные препараты и любые технологии лечения перед получением разрешения к использованию в практике, должны показать свое статистически и клинически значимое преимущество и эффективность, перед технологиями, применяемыми на настоящий момент времени. При этом безопасность для пациента предлагаемой технологии лекарственного препарата должна быть как минимум не меньше, чем у препаратов и технологий, применяемых на сегодняшний день. Общее время от момента появления гипотезы и разработки первичной молекулы препарата до момента включения лекарственного срества в клиническую практику может составлять до лет. При этом процесс внедрения проходит вначале этап лабораторных доклинических исследований, по результатам которых через разрешение государственных регуляторных органов и этического комитета, получается разрешение к применению не применению лекарственного препарата у человека.








Клинические испытания
Клиническое исследование — научное исследование эффективности, безопасности и переносимости медицинской продукции в том числе лекарственных средств у людей. Существует международный стандарт «Надлежащая клиническая практика». В Национальном стандарте Российской Федерации ГОСТР «Надлежащая клиническая практика» указан полный синоним этого термина — клиническое испытание, который, однако, менее предпочтителен из-за этических соображений.

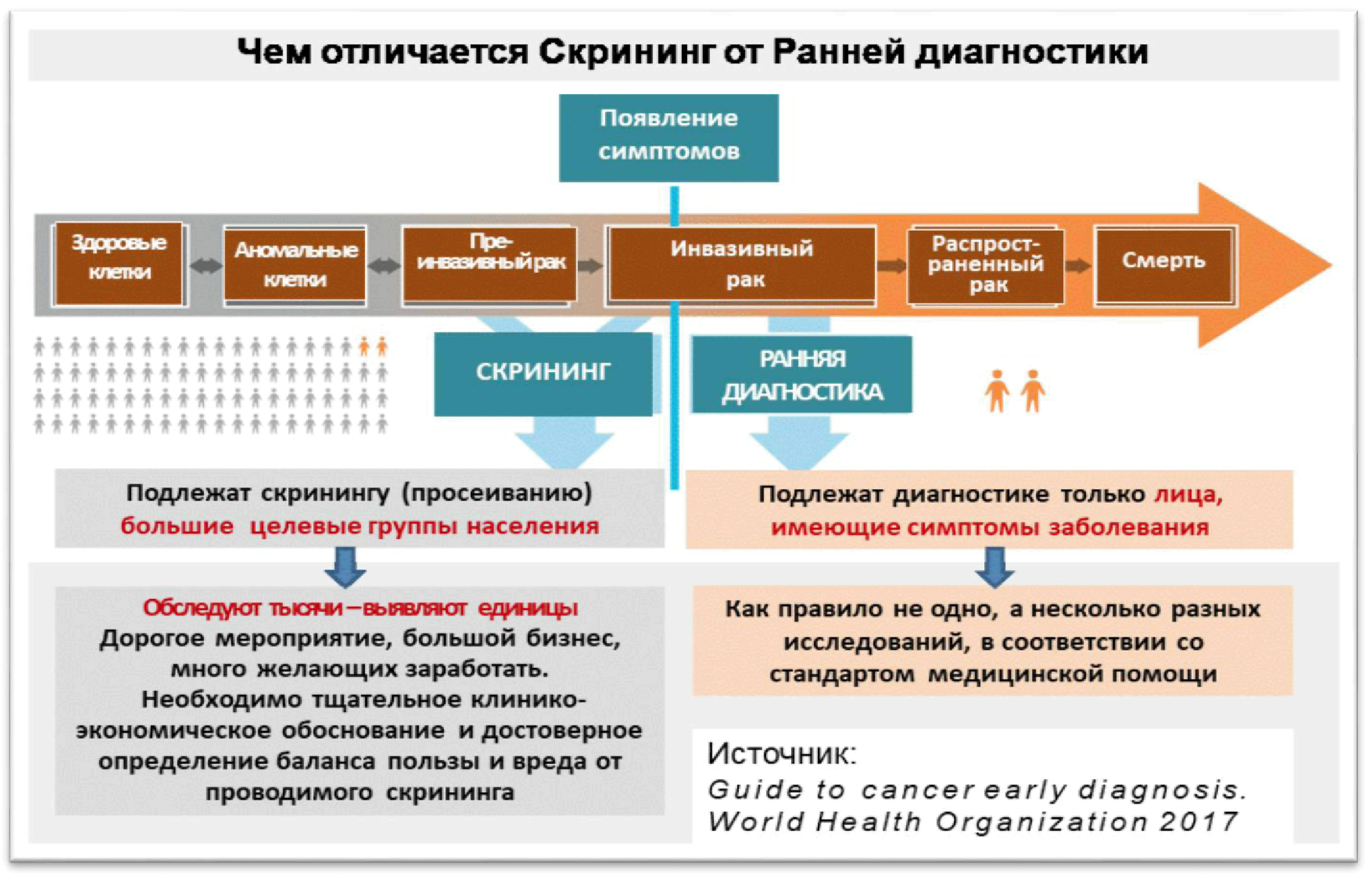








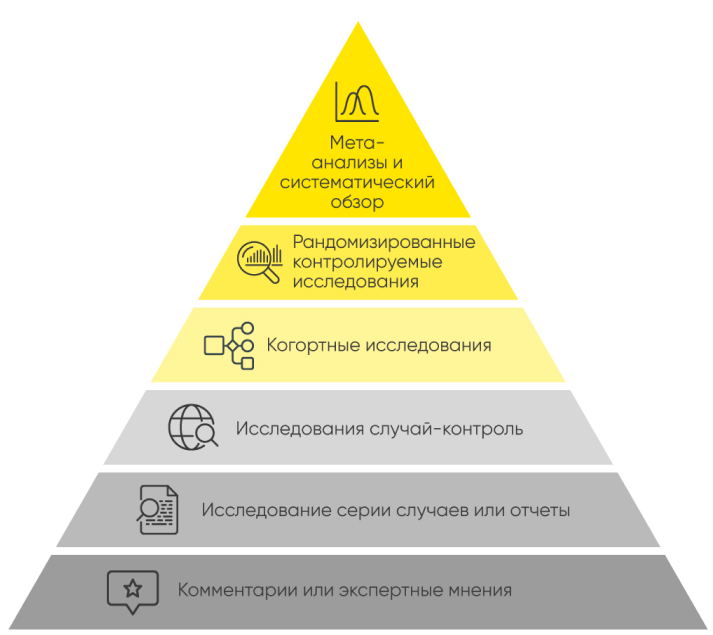
Клинические исследования КИ — это медицинские исследования с участием людей. Они всегда четко спланированы и проверены. Если исследование одобрено, значит, оно безопасно для участников, обеспечивает их защиту и достоверность результатов. КИ делятся на 2 группы: клинические интервенционные и наблюдательные обсервационные. В клинических испытаниях участники получают новый способ лечения в соответствии с планом например, новые таблетки , который сравнивается с уже существующими методами. В обсервационных исследованиях наблюдают за испытуемыми в обычных условиях и выясняют, как тот или иной фактор влияет на их здоровье.


.png/640px-WGCNA_outline_(russian).png)



